
Resposta imune e inflamação
Resposta imune e inflamação estão relacionadas? Já sabemos, de outro texto, que a invasão de nosso corpo por algo estranho levará a uma ação de células do sistema imune, o que chamamos de resposta imune. Como também já escrevi, temos contato constante com o meio e muitas vezes somos invadidos. Não percebemos porque algumas células do sistema imune “residem” em nossos órgãos e eliminam o invasor prontamente.
Eliminá-lo prontamente significa que a invasão terminou e que ninguém precisa saber disso (nós ou o restante do sistema imune). Mas, caso não seja tão rápido ou “fácil” eliminar o invasor, outros componentes do sistema imune deverão ser recrutados. Nessa situação, todo mundo é avisado: nós, que perceberemos os sinais e sintomas de uma infecção (febre, batimentos cardíacos acelerados, mal-estar, cansaço ou fraqueza etc.), e os outros componentes desse sistema.
Trata-se de um esforço conjunto das duas partes do sistema imune, uma dita “inata”, e outra, “adaptativa”. Ao final, teremos eventos que levam muitas células e proteínas para dentro do órgão afetado. Com isso, o órgão (ou parte dele) fica aumentado de volume (inchaço), mais quente (muita energia está sendo gasta na “batalha”) e dolorido (restos da batalha e moléculas secretadas pelas células do sistema imune são irritativos e causam dor).
As alterações citadas acima constituem o que chamamos de inflamação. Assim, a resposta imune, com a potência que ocorre quando precisa nos defender de uma invasão mais perigosa, resulta em inflamação. Dando continuidade às repostas para as perguntas mais frequentes sobre a imunidade, percorreremos os passos desde o reconhecimento do invasor até a inflamação.
Pergunta n.6: O que é imunidade inata?
Temos uma primeira linha de defesa muito diversificada e bem posicionada, constituída de células, proteínas e outras moléculas altamente reativas (que atuam rapidamente ao contato com invasores). Parte dessa linha de defesa, as células sentinelas, está dentro de cada órgão. Elas monitoram o território constantemente e são capazes de detectar os invasores a partir do que estes secretam ou trazem em sua superfície.
Detecção do invasor
O invasor é detectado através de suas moléculas. É como se houvesse marcas ou pistas de sua presença, e as células sentinelas fossem capazes de reconhecê-las pelo toque. O toque é feito através de proteínas especiais que essas células têm em sua superfície, chamadas receptores (porque recebem as moléculas do invasor e nelas se encaixam).
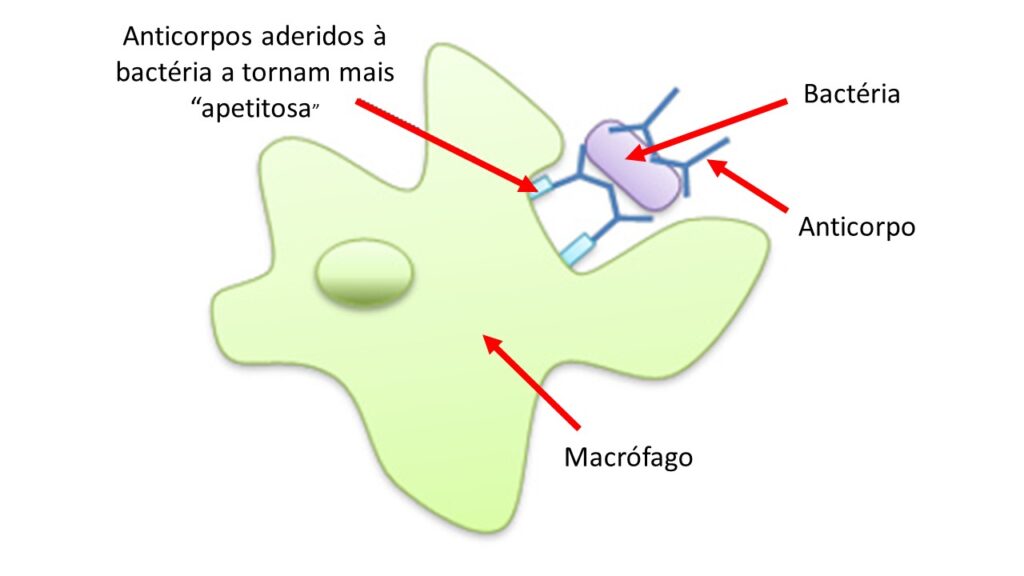
Cada receptor é apto a se ligar a alguns tipos de pistas e vai levar a determinado comportamento da célula sentinela. Desse comportamento faz parte a secreção de proteínas (chamadas citocinas e quimiocinas) que funcionam como sinais de alerta, recrutando outras células do sistema imune e permitindo que os vasos sanguíneos que nutrem o órgão se dilatem, resultando na passagem de líquido e proteínas do sangue para o local. A figura abaixo mostra um macrófago detectando uma bactéria e sofrendo modificações para produzir citocinas e quimiocinas.
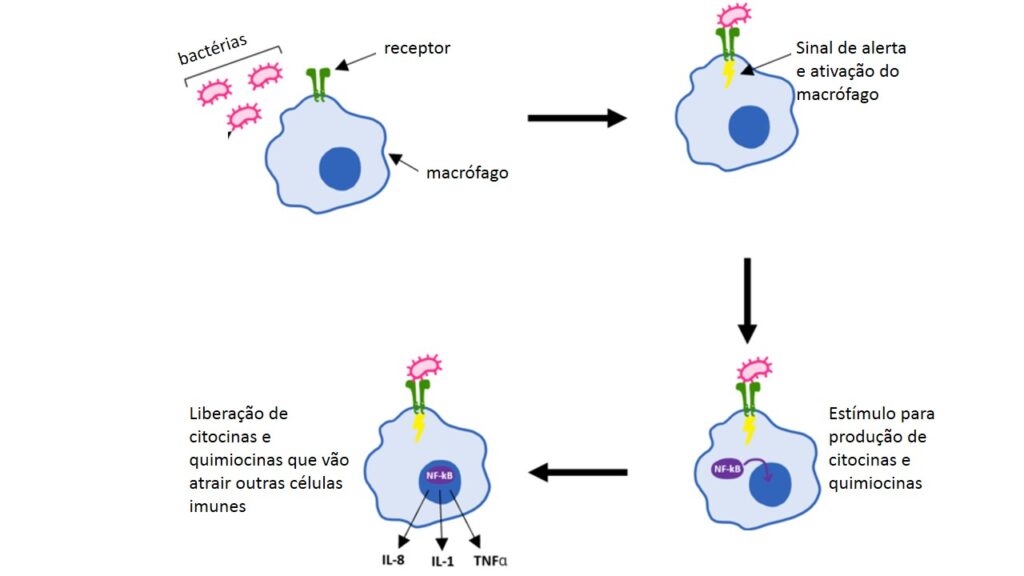
Possuímos algumas dezenas de receptores nas células sentinelas, o que permite que grande número de moléculas de invasores seja reconhecido. Isso com certeza garante o início de uma resposta imune a vários germes (vírus, bactérias, fungos etc.).
Células fagocíticas
As células sentinelas são especializadas em fagocitar. Fagocitar quer dizer englobar, engolir. Além de engolirem os invasores, essas células, na maioria das vezes, os digerem. Assim, são também chamadas de células fagocíticas. As mais importantes são os macrófagos, os neutrófilos e as células dendríticas. Todas elas mandam sinais após fagocitarem seus alvos.
Macrófagos e células dendríticas moram nos tecidos, enquanto os neutrófilos são células que residem na medula óssea (um regimento extra) ou circulam pelo corpo todo através do sangue. Quando as duas primeiras fagocitam um invasor e não conseguem eliminá-lo rapidamente, elas secretam citocinas e quimiocinas que vão funcionar como uma bandeira vermelha na porta do órgão, avisando que os neutrófilos devem parar e entrar para ajudar no combate.
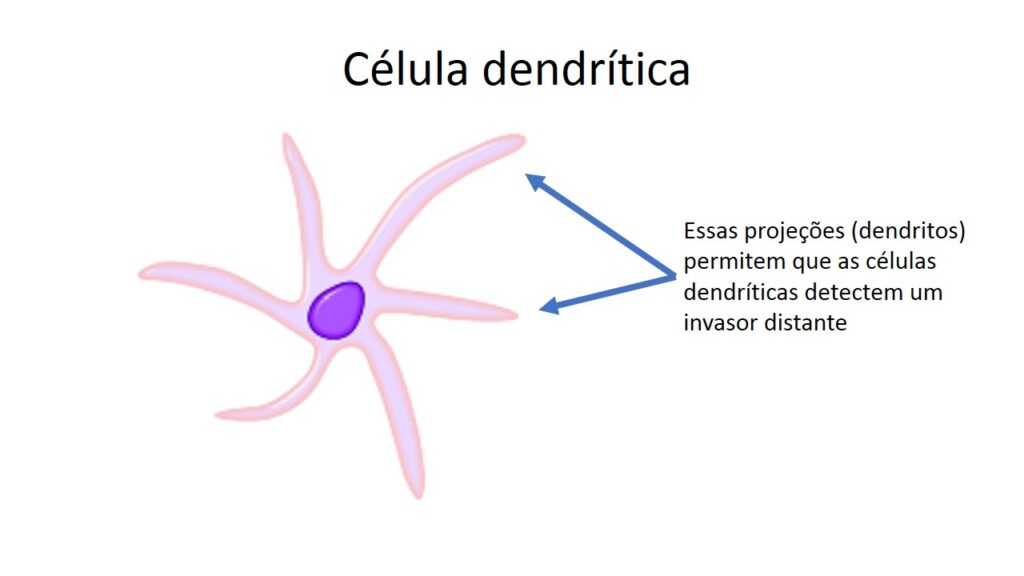
A fagocitose é o evento comum a essas células, mas há diferenças
Neutrófilos são muito potentes, produzindo compostos de oxigênio (água oxigenada e outros) e enzimas que reagem prontamente com o invasor e muitas vezes conseguem eliminá-lo. Além disso, são células que vão para a batalha para morrer. Quando morrem, liberam todas essas moléculas dentro do órgão, o que pode ser lesivo. E de fato é, contribuindo muitas vezes para a destruição das células do órgão invadido, mais que do próprio invasor. É um dos preços que pagamos quando temos que eliminar invasores mais resistentes e perigosos. A figura abaixo mostra um neutrófilo fagocitando uma bactéria.
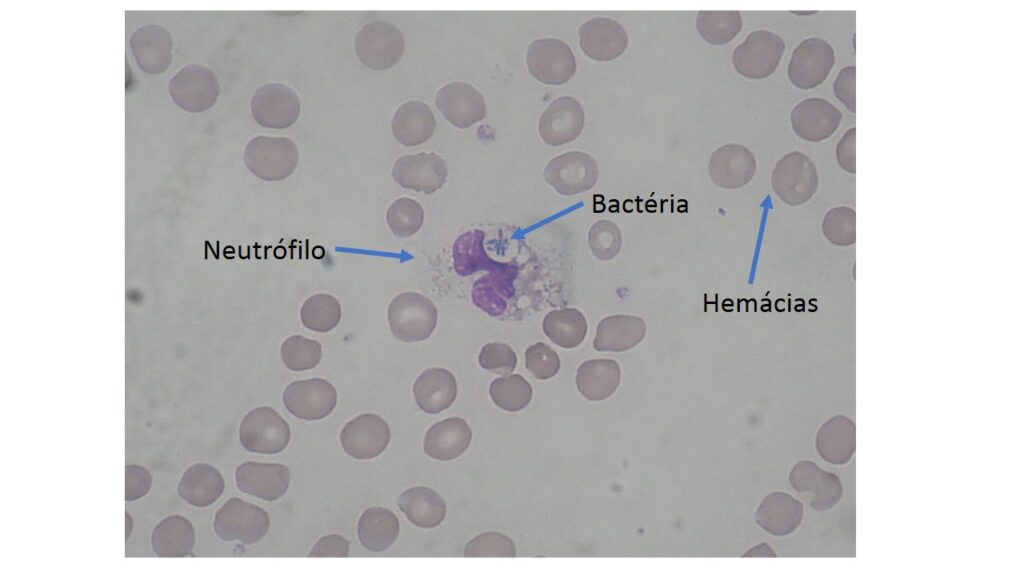
Você deve se lembrar de alguém mais velho passando algodão com água oxigenada em seus machucados. Isso pode ter alguma função, em especial porque o peróxido de hidrogênio (H2O2, composto da água oxigenada) pode mesmo matar bactérias. O problema é que o H2O2 também pode ser lesivo para o local machucado, atacando também as nossas células. Por isso, não é mais utilizado em tratamento de feridas. Mas, como muito em medicina “vai e vem”, ou seja, é usado, depois proibido, depois usado de novo, há estudos testando se há concentrações e formas (pomadas, por exemplo) em que o H2O2 pode ser útil em matar os germes sem lesar nosso corpo.
Apresentação do invasor
Os outros dois tipos celulares, além de fagocitarem, têm outra função essencial, que é a apresentação do que foi fagocitado. Não a apresentação de qualquer forma, mas de um jeito que outras células possam reconhecer partes do invasor e se organizar a partir disto. Para essa apresentação especial, macrófagos e células dendríticas quebram o agente invasor e separam suas proteínas em pedaços bem pequenos, chamados peptídeos.
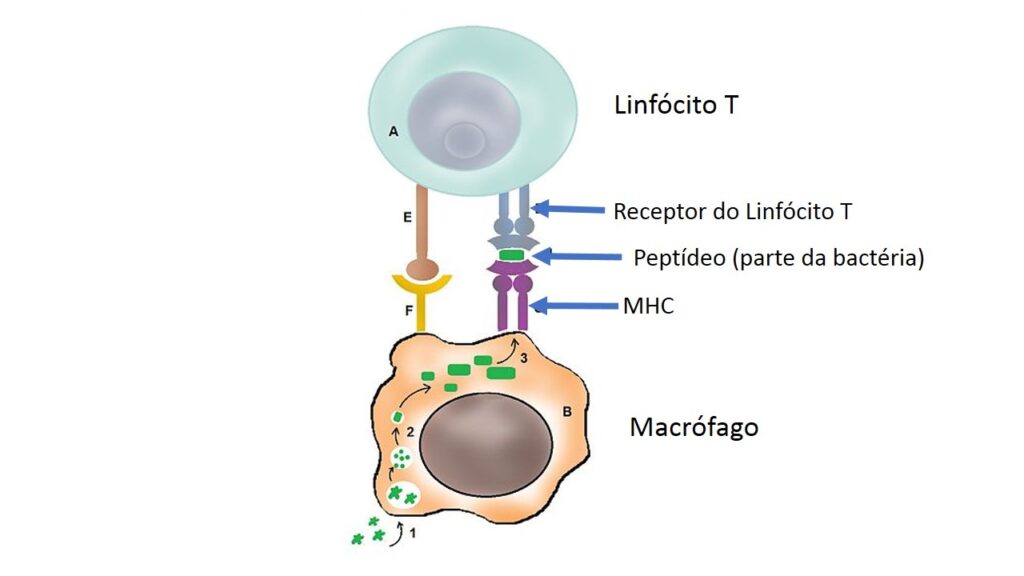
Os peptídeos são encaixados em outro tipo de moléculas que ficam na superfície dessas células, chamadas, em conjunto, de complexo principal de histocompatibilidade (ou, pela sigla em inglês, MHC). É dessa forma, com pequenos pedaços de proteínas dos invasores encaixados em moléculas do MHC, que macrófagos e células dendríticas vão informar a outras células sobre a natureza do invasor. O processo é mostrado na figura abaixo:
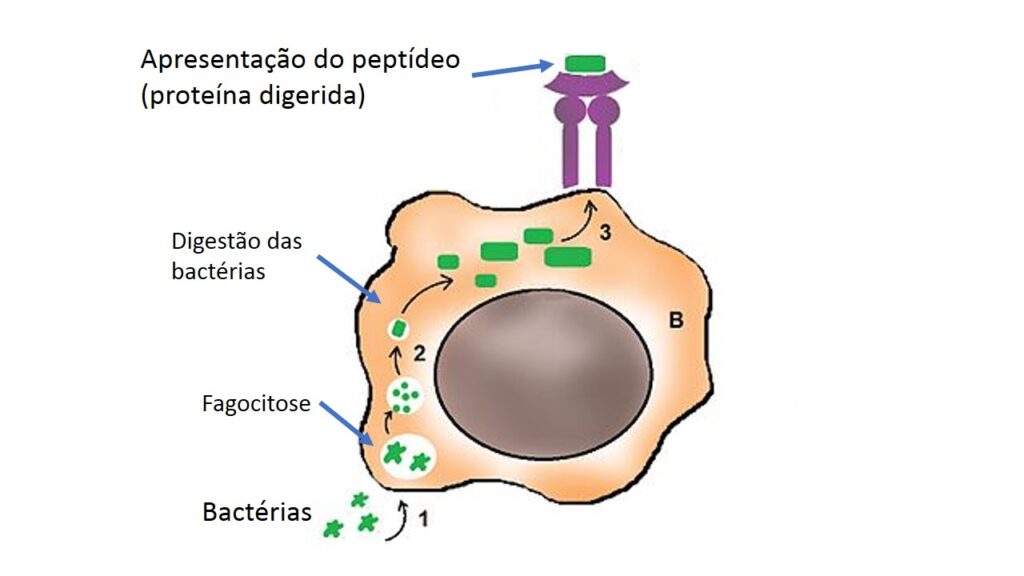
Os macrófagos fazem apresentação restrita ao local em que residem, já as células dendríticas viajam (pela linfa, como discutimos em outro texto) até os quartéis generais do sistema imune, os linfonodos. Nesses locais, vão informar aos linfócitos sobre o perigo que nos ronda.
Há outras células que podem realizar fagocitose (eosinófilos, basófilos e mastócitos, por exemplo), mas têm funções específicas, em especial na resposta contra vermes e em processos alérgicos. Por isso, fogem ao nosso objetivo geral.
Proteínas que arrebentam os invasores – O Sistema Complemento
As primeiras proteínas importantes na luta contra invasores são chamadas coletivamente de Sistema Complemento. O termo “complemento” vem da época de seu descobrimento, ainda no século XIX, quando foi identificado um “fator” sanguíneo que complementava o efeito dos anticorpos. Por ter efeito de aumentar, ou complementar, a função destruidora de germes típica dos anticorpos, esse fator foi chamado de Complemento.
Hoje sabemos que esse sistema é ativado em “cascata”, ou seja, uma proteína ativa a subsequente, até a última, em uma cadeia. Ao final, é formada uma estrutura em forma de tubo e este tubo perfura os germes, arrebentando-os.
Algumas das proteínas do Sistema Complemento têm também a função de tornar germes e suas moléculas secretadas apetitosos para as células que fazem fagocitose.
Opsonização
O processo de se depositar em um invasor e o tornar apetitoso para o sistema imune leva o nome de opsonização (opson, do grego, significa tempero). E às proteínas que fazem isso damos o nome, coletivamente, de opsoninas. Como dito acima, algumas proteínas do Sistema Complemento são opsoninas.
Outras moléculas do sangue também têm função de opsonização e são importantes. Uma delas merece destaque, em especial porque há uma grande chance de você já ter feito um exame com seu nome: Proteína C-reativa. Se não o fez, fará em algum momento.
Proteína C-reativa
A Proteína C-reativa é produzida principalmente no fígado, em resposta à circulação das citocinas produzidas pelas células fagocíticas (macrófago e células dendríticas) do local em que houve a invasão. Foi identificada pela primeira vez em indivíduos com pneumonia causada pela bactéria estreptococo, como um “fator” presente no sangue e capaz de reagir (ou seja, de se ligar) com o açúcar “C” da cápsula dessa bactéria. Depois, foi visto que a Proteína C-reativa aparecia em grandes quantidades no sangue de indivíduos mesmo sem infecção por essa bactéria. O que eles tinham em comum era a presença de uma inflamação “sistêmica”. Sistêmica quer dizer que a inflamação foi além do órgão incialmente invadido (por exemplo, nos casos de pneumonia, além do pulmão doente).
Vários eventos podem causar inflamação sistêmica: infecções graves de diversos órgãos, traumas físicos (acidentes), queimaduras, grandes cirurgias, cânceres e doenças autoimunes. Se você gosta de ir à praia e se transformar num “camarão”, saiba que sua pele está sofrendo queimaduras de segundo (às vezes, terceiro) grau. Isto vai levar à morte de células da sua pele. Em seguida, células do sistema imune terão de ir ao local para reparar o dano físico que você sofreu. Parte da ação do sistema imune leva ao “vermelho camarão”, inchaço e formação de bolhas. Se você fizer o exame que avalia a Proteína C-reativa em seu sangue, há grande chance de ela estar em níveis elevados.
Outra utilidade de se dosar essa proteína no sangue (e por isso é muito provável que você fará o exame) é que ela é um bom indicador de inflamação dos vasos sanguíneos, mesmo na ausência de uma das situações citadas acima. Pessoas sedentárias, que se alimentam mal, fumam e têm outras doenças (diabetes e alterações dos triglicérides e do colesterol) que aumentam a chance de infarto ou derrame (acidente vascular encefálico), frequentemente têm aumento da Proteína C-reativa no sangue. Assim, ela se torna um marcador do risco de ter doenças cardiovasculares (de especial utilidade porque são doenças que não dão recado, ou seja, não costumam apresentar sintomas antes de acontecerem).
Pergunta n.7: O que é imunidade adaptativa?
Imunidade adaptativa é um conjunto de elementos do sistema imune altamente específicos para o invasor. Nosso sistema imune é capaz de organizar uma resposta específica para milhões de estruturas (proteínas, açúcares, lipídios, DNA, RNA etc.) presentes em milhares de invasores. A resposta específica ocorre através das funções de linfócitos B (produtores de anticorpos) e linfócitos T (auxiliam outras células imunes ou atacam células infectadas).
Linfócitos T auxiliares
Precisamos retomar o assunto da apresentação de peptídeos através do MHC. É essa apresentação que vai definir qual linfócito T será ativado. Em outras palavras, é nesse passo que a célula fagocítica vai selecionar qual linfócito vai ser convocado para a batalha e quais os (inúmeros outros) que não o serão.
Relembro um detalhe: a célula fagocítica (neste caso, quase sempre uma célula dendrítica), depois de engolir, digerir o invasor e colocar peptídeos deste no MHC, migrou, através dos vasos linfáticos, até um linfonodo. No linfonodo é que poderá “escolher” os linfócitos mais apropriados à eliminação do invasor.
Não faz sentido chamar todos os linfócitos. Seria um erro por muitos motivos, dos quais cito dois: além de um grande uso de energia, a utilização de armas ineficazes contra o invasor. Ambos os motivos levam a um custo altíssimo com raro benefício.
Os linfócitos T também têm receptores em sua superfície. É nesses receptores que há a definição de quem será ou não chamado. Os receptores se encaixam na molécula do MHC (presente na célula dendrítica) e reconhecem o pedaço da proteína apresentado. Quando alguns linfócitos T (sim, vários pedaços de proteínas do invasor são apresentados ao mesmo tempo no MHC) são recrutados, eles se multiplicam milhares de vezes e partem para o local da invasão. A figura abaixo mostra a ativação de um linfócito T por um macrófago.
Alguns invasores escapam da nossa resposta imune porque as células fagocíticas não conseguem apresentar partes deles no MHC. Para outros, embora partes suas sejam apresentadas pelos fagócitos, não há os melhores linfócitos para responder ao chamado. Ser mais ou menos específico para o invasor tem a ver com o melhor encaixe entre o receptor do linfócito e o MHC contendo o peptídeo (que, para relembrar, é um pedaço de proteína do invasor). Se o encaixe é perfeito, o linfócito será ativado com potência máxima. Se for frouxo, com baixa potência. Se não ocorrer, não haverá resposta contra aquele pedaço da proteína do invasor. O último caso pode facilitar a vida do invasor e permitir que ele se multiplique e espalhe por nosso corpo. Há chance, infelizmente, de perdermos a batalha.
Os linfócitos T acima descritos são chamados de auxiliares, pois, uma vez ativados, vão para o local da infecção ajudar na ativação de outras células, como os linfócitos B e mesmo os fagócitos, que ficam com ainda mais apetite e mais capazes de digerir o invasor.
O modo de resposta descrito até aqui serve para a maioria das bactérias e dos fungos. E para os vírus?
Outro tipo de linfócitos T
Há um outro grupo de linfócitos T, chamados de citotóxicos. Como o nome sugere, reagem contra células, células estas do nosso próprio corpo. Em situações normais, esses linfócitos não reagem contra nossas células saudáveis. Mas, uma vez infectadas por vírus, as células de nossos órgãos colocam partes de proteínas dos vírus em sua superfície, também em moléculas de MHC. O fato de apresentar uma proteína estranha no MHC faz com que seja possível a ligação forte com o receptor do linfócito T. A consequência disso é a ativação dos linfócitos T, de forma semelhante à que fazem as células fagocíticas.
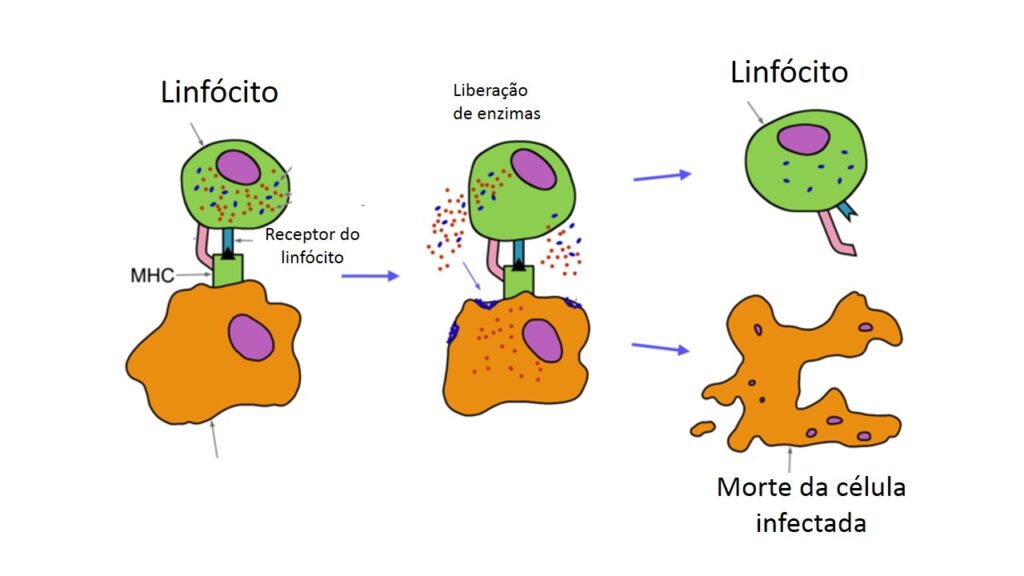
A diferença aqui está no fato de que essas células são “programadas” para destruir quem apresentar o encaixe para seus receptores. Se houver encaixe, esses linfócitos liberam enzimas sobre a célula alvo e a eliminam (ver figura abaixo). Embora a célula do próprio corpo também morra, este é o mecanismo de que o corpo dispõe para combater os vírus, já que se trata de invasores que sobrevivem e se multiplicam dentro das células. As bactérias, ao contrário, na maioria das vezes sobrevivem e se multiplicam fora da célula, e são alvos fáceis para os anticorpos (como veremos adiante).
Alguns vírus escapam da apresentação de suas proteínas no MHC, evitando, assim, a resposta imune. São exemplos o citomegalovírus, os vírus das hepatites B e C e o HIV.
Outra situação em que os linfócitos T citotóxicos são essenciais é na resposta imune contra células tumorais. De forma muito simplificada: grande parte das células que se transformam em tumorais passa a produzir proteínas modificadas ou proteínas que não deveriam ser produzidas naquele órgão. Dessa forma, por serem estranhas, essas proteínas são quebradas dentro da própria célula e apresentadas no MHC, podendo ser encontradas pelos linfócitos T citotóxicos. As células sofrerão o ataque destes, possibilitando que um futuro câncer seja evitado. À semelhança de alguns vírus, alguns tipos de células tumorais conseguem escapar da ação dos linfócitos T citotóxicos, resultando no surgimento de cânceres.
Linfócitos B e anticorpos
Com relação aos linfócitos B, a situação é um pouco diferente. Essas células também têm receptores em sua superfície, com um detalhe: esses receptores são imunoglobulinas M (IgM, um tipo de anticorpos). As IgM fazem ligação menos firme (mas suficiente) com o invasor. Interessante saber que, diferente dos receptores de linfócitos T, que somente se ligam a partes de proteínas (peptídeos), os receptores dos linfócitos B, por serem anticorpos, se ligam a moléculas de várias naturezas – açúcares compostos, lipídios, proteínas de diversos tamanhos, DNA, RNA etc.
Neste ponto, um novo conceito precisa ser introduzido, o de “antígeno”. Antígeno é o nome que se dá a todas as moléculas que são reconhecidas pelos receptores dos linfócitos T (tanto os auxiliares quanto os citotóxicos) ou pelos receptores dos linfócitos B (ou seja, anticorpos).
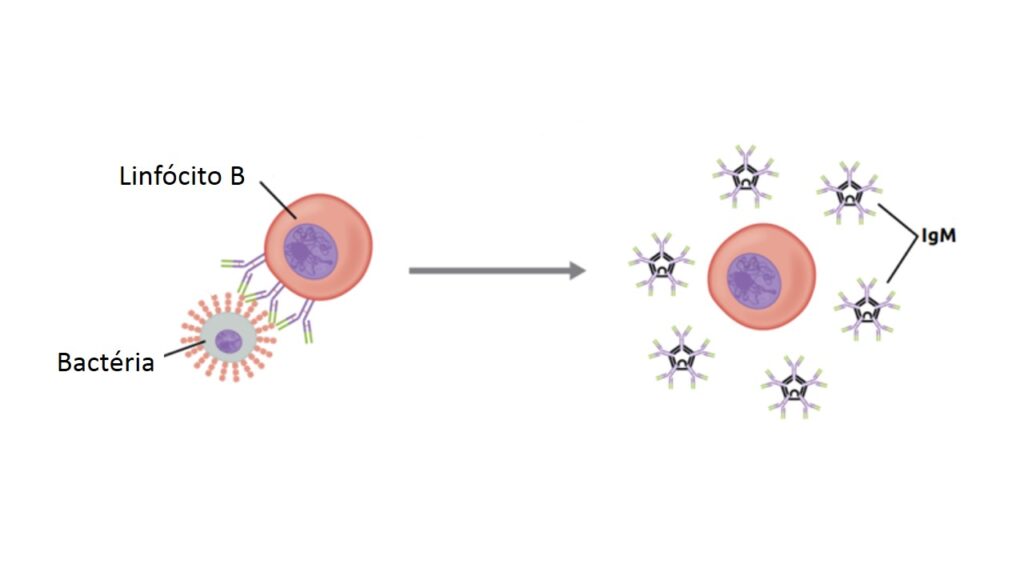
À semelhança dos linfócitos T, cada linfócito B também é específico para determinado antígeno. Quando encontra esse antígeno, o linfócito B é ativado, se multiplica milhares de vezes e começa a produzir intensamente seu receptor (IgM) e a liberá-lo para o sangue, de forma que esse anticorpo possa percorrer o corpo todo. O processo pode ser visto na figura abaixo:
Além de se multiplicar, em torno de 5 a 7 dias após seu encontro com o invasor, o linfócito B faz uma mudança na produção do anticorpo, deixando de produzir IgM e passando a produzir imunoglobulina G (IgG). A IgG é um anticorpo que se liga muito mais fortemente ao antígeno do invasor e, por isso, é capaz de desencadear uma resposta imune mais potente.
Como os anticorpos funcionam?
Já sabemos que os anticorpos têm essa capacidade de reconhecer o que é estranho, mas como eles atuam para nos defender? Vamos, primeiro, olhar para uma molécula de IgG:
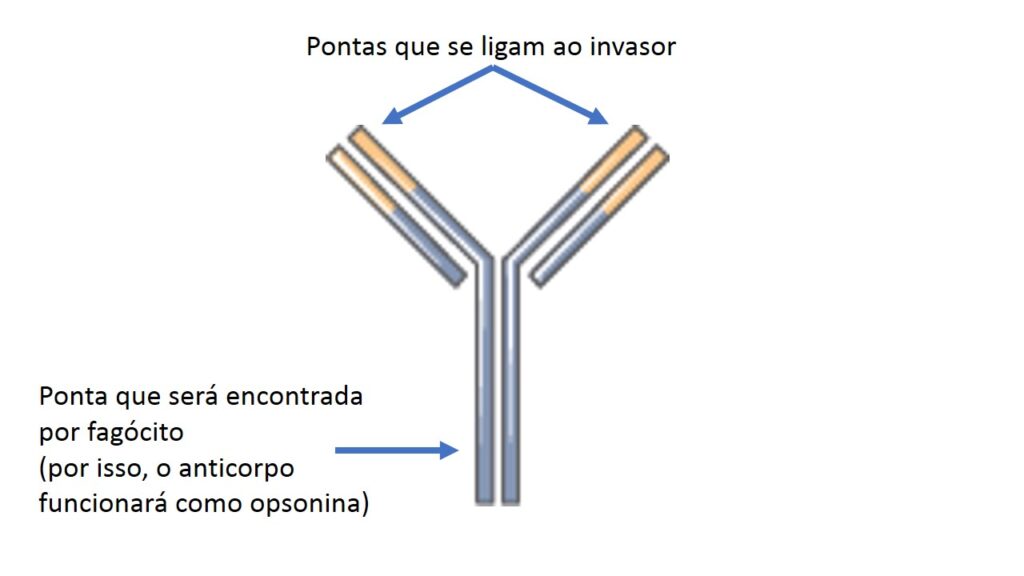
Note que o anticorpo tem uma estrutura do tipo forquilha ou ípsilon. Nas duas pontas do ípsilon estão as regiões que se encaixam no antígeno. É nessas pontas que há a enorme variedade de possibilidade de reconhecimento de invasores. Quando as pontas encontram seu antígeno, a ligação é forte e não se desfaz. A extremidade que ficou livre é praticamente igual para todos os anticorpos que temos e é ela que tem a função de ativar a resposta imune contra o invasor. Essa região pode atrair e ativar o Sistema Complemento e este pode estourar o invasor, como já sabemos. Ainda, essa região pode ser encontrada por células fagocíticas e estimulá-las a comerem o invasor. Em outras palavras, os anticorpos também são opsoninas.
Se você algum dia ouviu o termo “imunidade humoral”, nada mais é que a produção de anticorpos (em alguns textos, as proteínas da imunidade inata – Sistema Complemento, Proteína C-reativa etc. – também podem ser incluídas no termo humoral).
Um último detalhe. Os linfócitos B também ficam (como os linfócitos T) de prontidão em órgãos linfoides (linfonodos, aglomerados linfoides no intestino e nos pulmões, amígdalas e adenoides e apêndice vermiforme, aquele do intestino). Assim, embora os linfócitos B possam, por conta própria, encontrar o invasor, isto é menos provável. Seu encontro também ocorre nesses órgãos linfoides, que recebem os invasores (inteiros ou em pedaços) através da linfa, permitindo o contato direto. As células dendríticas, tão importantes para a apresentação dos invasores aos linfócitos T, também são importantes na apresentação de antígenos aos linfócitos B.
Memória de anticorpos e linfócitos T
Na maioria das vezes em que uma resposta imune específica (adquirida) é desenvolvida, ela fica guardada na memória do sistema imune. Isso ocorre porque parte dos linfócitos T e B que se multiplicaram e especializaram na defesa contra determinado invasor migra para linfonodos, baço e medula óssea e nesses locais permanece “dormitando” até que seja recrutada numa eventual nova invasão. Se isso ocorrer, o sistema imune estará pronto, pois já sabe o que fazer. A resposta imune no segundo contato com o invasor é sempre mais rápida e potente.
Pergunta (quase nunca feita, mas importante) n.8: O que é inflamação?
Agora que já sabemos um tanto sobre boa parte (não todos!) dos eventos da resposta imune, podemos conversar sobre seu resultado para o órgão acometido pelo invasor, que é a inflamação.
A inflamação começa quando os fagócitos do sistema imune inato detectam o invasor e começam a lutar com ele, ao mesmo tempo enviando mensagens sobre a invasão. Como vimos, nesse processo, os vasos sanguíneos do órgão tornam-se permeáveis às células do sistema imune que estão no sangue (neutrófilos, principalmente) e à agua e às proteínas. O local vai ficando progressivamente mais inchado à medida que mais e mais desses componentes comparecem para a luta.
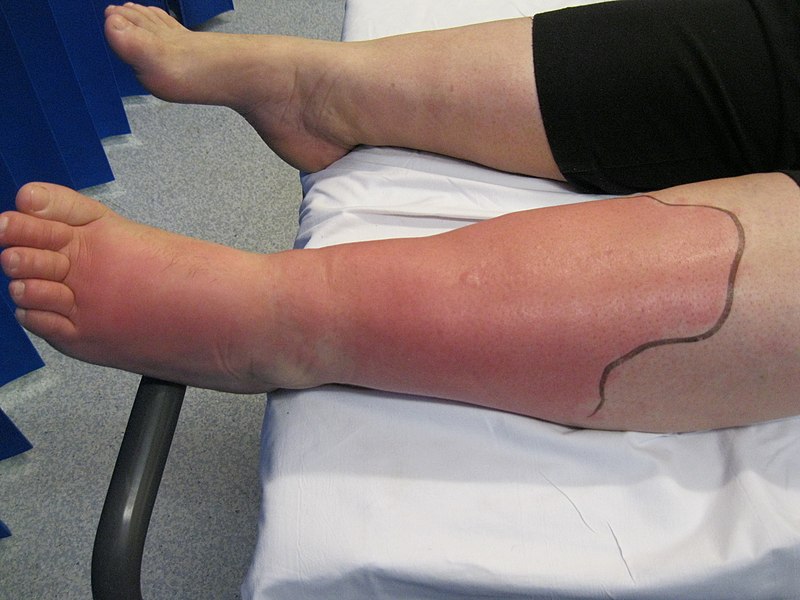
Dentro de algumas horas notaremos o resultado: dor, vermelhidão, calor e inchaço, se o órgão for visível (por exemplo, numa infecção de pele ou de garganta); caso não seja visível, poderemos ter sintomas do envolvimento do órgão interno (por exemplo, tosse, produção de catarro, dor para respirar e falta de ar, nos casos de infecções pulmonares). A figura abaixo mostra um tipo de infecção bacteriana da pele, chamada celulite. Note o inchaço e a vermelhidão. A perna e o pé também estão quentes e doloridos.
Nos dias seguintes haverá acentuação das atividades do sistema imune, com maior recrutamento ao órgão afetado. Há intensa atividade de ambos os lados em combate, sem que a vitória se aproxime. Isto tem uma consequência: os restos da batalha (do invasor e de nossos soldados) se acumulam e causam dano às células locais. Estabelece-se um círculo de mais e mais recrutamento e inflamação. Nesse ponto, poderemos apresentar febre, mal-estar, falta de apetite etc.. Isso significa que a mensagem enviada pelos fagócitos no campo de batalha é muito intensa e está mobilizando recursos de todo o corpo.
Essa fase coincide com a organização da resposta imune específica. Órgãos como os linfonodos estão trabalhando intensamente e elaborando o melhor ataque. Feito isso, nos próximos dias, essas células migram até a batalha e tomam conta das ações, melhorando as estratégias, facilitando a ação dos fagócitos (pela presença de anticorpos, por exemplo), estimulando a eliminação do invasor (pelos linfócitos T auxiliares). É quando a guerra começa a ser vencida.
Um detalhe: para muitas dessas infecções precisaremos dar um reforço ao sistema imune. Esse reforço vem na forma de antimicrobianos, remédios específicos para vírus, bactérias, fungos e outros tipos de invasores.
Ao passo que os invasores morrem mais que nossos soldados, a guerra vai sendo ganha, o local vai sendo limpo e a intensidade da resposta imune diminui. Diminuem também os sinais da inflamação – menos inchaço e calor, a vermelhidão começa a esmaecer, a dor desparece e não temos mais febre. Nosso apetite retorna, bem como nossa disposição. Isso é chamado de resolução da inflamação, processo tão importante quanto o da resposta imune em si.
Final feliz! Pena que algumas vezes ele não ocorra, afinal, não somos super-humanos. Espero que nunca sejamos, mas isso é outro assunto…
Curiosidades
1. MHC e transplantes – Um dos principais problemas com relação aos transplantes é encontrar doador compatível com relação ao MHC. Os linfócitos citotóxicos de cada um de nós reconhecem como não estranho o MHC produzido por nossas células, mas podem reconhecer como estranho o MHC produzido pelas células do órgão transplantado. Por serem determinadas geneticamente, as moléculas do MHC só são idênticas entre gêmeos idênticos. Para o transplante, tenta-se encontrar pessoa com MHC mais parecido (ou compatível) possível. Mesmo assim, às vezes o MHC das células recebidas é reconhecido como estranho e as células do órgão transplantado são atacadas pelos linfócitos T de quem recebeu a doação, com chance de perda do órgão (situação chamada de rejeição).
2. A mudança de produção de anticorpos IgM para anticorpos IgG ocorre também após vacinações. Como essa mudança leva até 14 dias para ocorrer, esse é o tempo mínimo que se deve esperar entre a imunização (vacinação) e a possível exposição (por exemplo, uma viagem a algum local em que se pode adquirir a infecção). Além disso, esse tempo de mudança de IgM para IgG é útil para o diagnóstico de grande parte das infecções. Se um indivíduo tem apenas IgM para determinado germe, está no início do processo infeccioso; se tem IgM e IgG, a infecção ocorre há 10 dias ou mais; e se tem apenas IgG, o quadro clínico atual não é o da infecção, pois ter somente IgG é sinal de evento passado.
3. O apêndice vermiforme, retirado cirurgicamente quando as pessoas sofrem de apendicite, é parte do sistema imune. Nele há concentração de células dendríticas e linfócitos, sendo importante na organização da defesa que existe em nossos intestinos e na manutenção de interação harmônica do nosso corpo com bactérias úteis para a saúde.

Como melhorar a imunidade?

Voo do morcego e a ultrassonografia
Você pode gostar

Estresse: amigo ou inimigo?
maio 6, 2023
Sua vida por um sabão
março 18, 2023
Um comentário
Letícia Fernandes
👏🏻👏🏻👏🏻