
Sua vida por um sabão
Um sabão permitiu que você sobrevivesse. Aliás, não apenas um, mas uma mistura de alguns sabões em água. E nem me refiro a questões de higiene e limpeza, como você perceberá ao ler esse texto.
Os sabões
Os sabões são sais cujos ânions são ácidos graxos (lipídios – ou, simplificando, gorduras). Esses ácidos graxos têm uma estrutura química peculiar, composta por longa cadeia de hidrocarbonetos (átomos de carbono ligados entre si e a átomos de hidrogênio) e uma terminação carboxílica (ácido carboxílico). Em nossos tanques e pias temos pedras ou pós de uma combinação desses sais, dentre eles o estearato (cujo cátion pode ser o sódio). A fórmula estrutural do estearato de sódio está na figura abaixo. Note a longa cadeia de hidrocarboneto, com o radical carboxila em uma das extremidades.
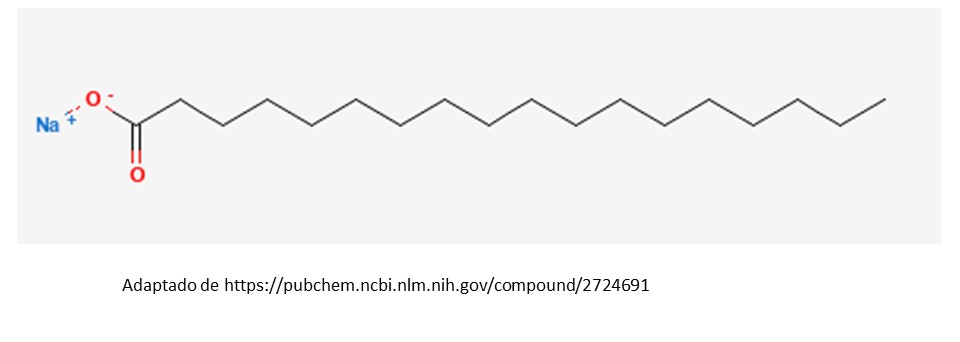
Perceba que uma de suas extremidades tem carga (dita polar), enquanto a outra, não (apolar). A molécula de água, por sua vez, embora tenha carga neutra, tem polaridade em decorrência de sua forma tridimensional, resultando em predomínio de carga negativa em um polo da molécula, e carga positiva no outro.
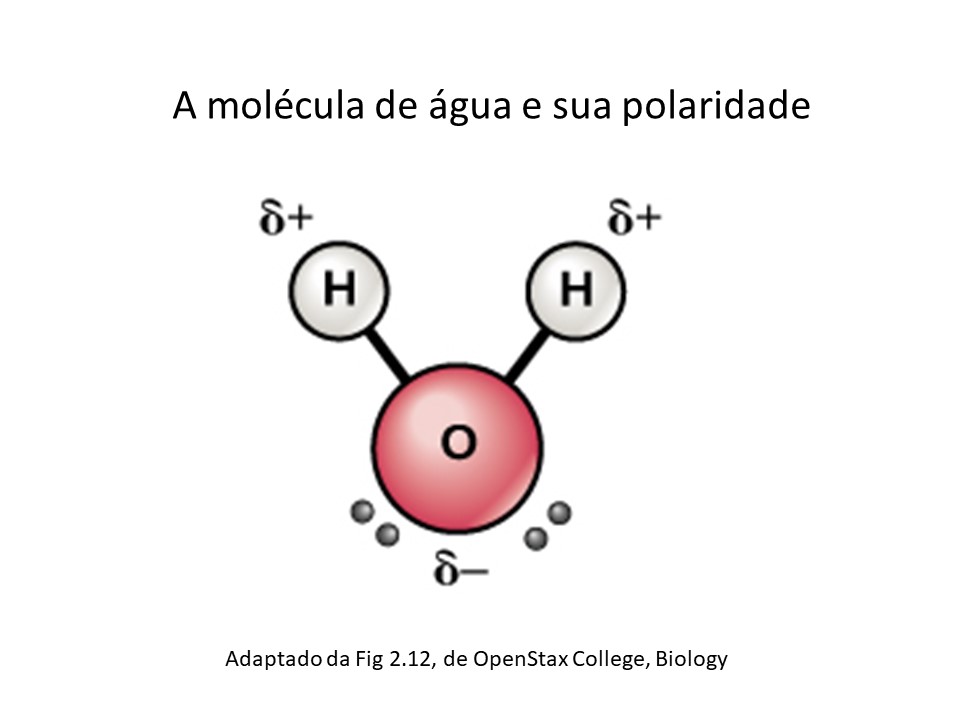
Quando em contato com a água, a molécula do sabão tem comportamento duplo – uma de suas extremidades, a polar, atrai moléculas de água (hidrófila), enquanto a outra, apolar, as repele (hidrófoba). Os sabões conseguem cumprir o papel de limpeza no nosso dia a dia porque sua extremidade hidrófoba se liga às moléculas de sujeira, enquanto sua extremidade hidrófila se liga à água. O fluxo de água leva junto a molécula de ácido graxo (sabão) e a sujeira.
Tensão superficial da água
As moléculas da água atraem-se umas às outras e em todas as direções. Isso vale para todas as moléculas de água em um recipiente, exceto para as da superfície, na interface com o ar. Estas são atraídas apenas pelos lados e para baixo (Figura).
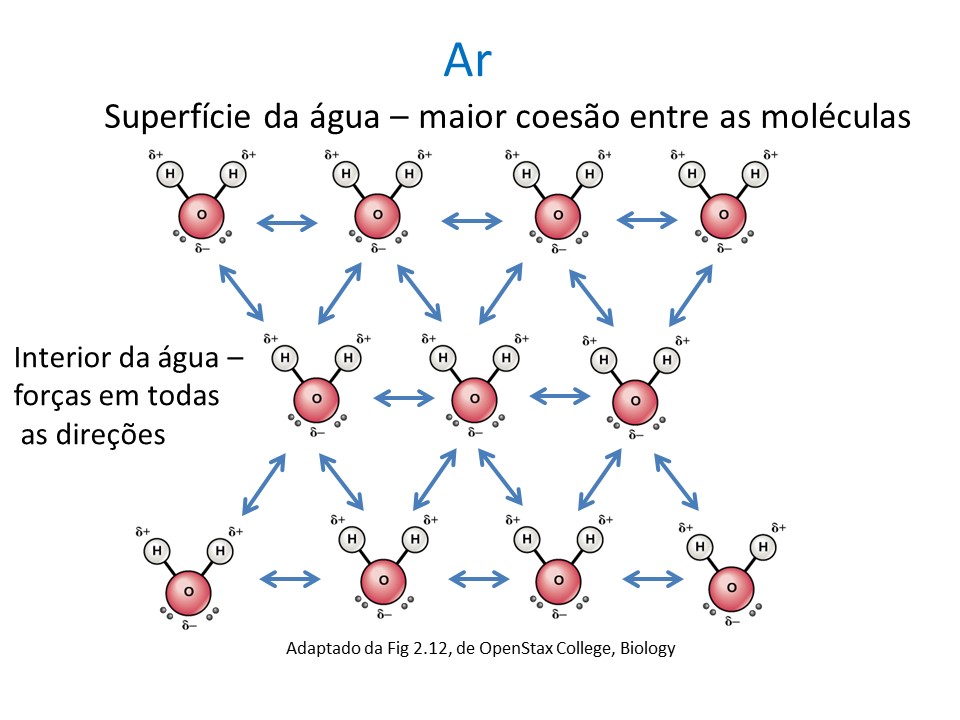
Essa resultante de forças nas moléculas de água que se encontram na superfície é o que se convencionou chamar de tensão superficial da água. Simplificando, é como se as moléculas superficiais da água constituíssem uma fina, mas resistente, membrana elástica.
Para nós, humanos, essa tensão superficial passa despercebida o tempo todo, mas é possível senti-la se colocarmos no mais leve contato o dedo indicador, ou mesmo a mão espalmada, na superfície da água em uma panela ou no tanque de lavar roupas. Se você forçar o dedo ou a mão para o fundo, verá que é fácil romper a tensão superficial. Isso ocorre porque o peso de nossa mão ou a energia cinética de seu movimento superam em muito a tensão superficial da água.
Tensão superficial no dia a dia
Num dia de chuva, a água cai na forma de gotas e quando se deposita numa superfície, o faz também na forma de gotas. A tensão superficial é a responsável por determinado volume de água, em contato com o ar, formar gotas.

Apesar disso, muito provavelmente você já fez experimentos com a tensão superficial da água, sem saber: lembra-se de colocar uma folha ou um barquinho de papel para descer na enxurrada logo após a chuva? Pois é, era a tensão superficial da água que os carregava na superfície. Mas, se você colocou peso sobre a folha ou o barco e parte deles submergiu, a membrana elástica de água foi rompida e ambos continuaram a descer a correnteza devido à flutuação, fenômeno decorrente do empuxo. Não confundir tensão superficial com empuxo (a força que mantém flutuando uma massa gigantesca como a de um transatlântico).
Alguns insetos conseguem pousar ou mesmo se locomover sobre a água por dois dos motivos descritos acima: a tensão superficial da água aliada a uma cobertura de suas patas por substâncias hidrófobas (Figura).

Tensão superficial e as bolhas de sabão
Folhas de árvores, barcos de papel e insetos não vencem a tensão superficial da água por serem relativamente leves (ou terem massa distribuída por superfície suficientemente grande, a ponto de não vencerem a tensão em nenhum ponto de apoio).
É a tensão superficial da água que, por ser “grande”, impede que façamos bolhas na água que sai de nossas torneiras. Além disso, a água evaporaria muito rapidamente, e a bolha teria vida muito curta. Ao adicionarmos sabão, afastamos as moléculas de água umas das outras, reduzindo a força de interação entre elas em toda massa de água, inclusive para aquelas da superfície. Isso possibilita que uma película de água seja expandida por ar. Mas não é só isso. No caso da bolha de sabão, a redução da tensão superficial vem acompanhada de outro fenômeno. A estrutura microscópica da parede de uma bolha de sabão é de uma camada de água revestida por dentro e por fora por uma camada de sabão (extremidade hidrofílica do sabão voltada para a camada de água).

Há diversos vídeos, na internet, sobre experiências de corpos (clipes metálicos, por exemplo) sustentados pela tensão superficial da água e como caem para o fundo do recipiente após ser adicionada uma gota de detergente (detergentes têm estrutura química semelhante à dos sabões).
Os sabões e os nossos pulmões
E, então, o que os sabões têm a ver com nossa sobrevivência?
Todos queremos ouvir o choro de uma criança assim que ela sai do ventre materno. É um momento de apreensão resolvido pelo berro esgoelado da criança. Para que isso ocorra, os pulmões, pouco expandidos e contendo líquido, devem receber ar em quantidade suficiente. Na palavra “suficiente” reside uma de nossas primeiras lutas pela sobrevivência. A figura a seguir mostra nossos pulmões (a); depois outra figura (b) somente com traqueia e brônquios, ou seja, os órgãos que permitem que o ar chegue ao fundo dos pulmões; por fim, o que há bem no fundo dos pulmões (em tamanho aumentado), os alvéolos (c).
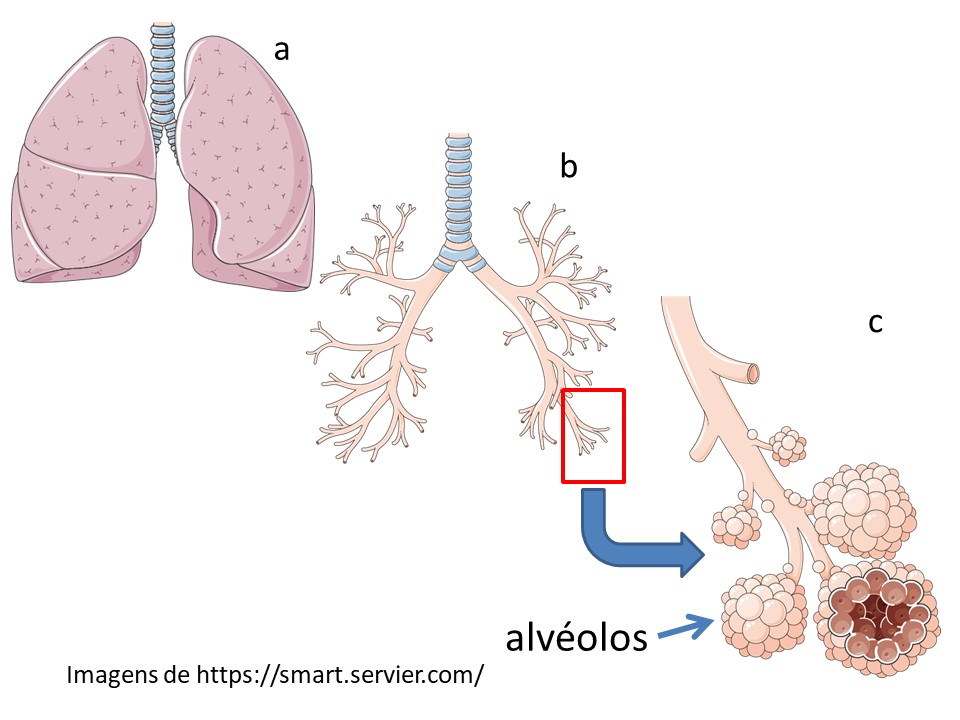
Nessas estruturas saculares, os alvéolos, é que ocorrem as trocas de oxigênio (do ambiente para o sangue) e gás carbônico (do sangue para o ambiente), essenciais para nossa sobrevivência. Para o ar chegar até lá, é necessária a ação dos músculos da caixa torácica e do diafragma, resultando em aumento de volume torácico e consequente pressão negativa dentro da caixa torácica. Essa pressão negativa é que permite expansão concomitante dos pulmões, causando abertura dos alvéolos para receber o ar do ambiente. A expansão pulmonar depende de sua elasticidade, e esta é dependente, entre outros fatores, da tensão superficial da água dentro os alvéolos que serão expandidos pela primeira vez.
Lembra-se de que os alvéolos tinham água e estavam pouco expandidos (sem ar)? Ou seja, temos uma estrutura sacular com uma membrana de água em seu interior. Na verdade, dizer que temos água é incompleto. Temos uma solução aquosa com diversas moléculas, dentre as quais sabões! E esses sabões é que permitem uma redução da tensão superficial da água dentro dos alvéolos e sua consequente expansão.
Os pulmões do recém-nascido
Se essas moléculas de sabão não estivessem no líquido dentro dos alvéolos, nossa primeira respiração seria muito difícil, talvez até impossível, pois a musculatura respiratória (caixa torácica e diafragma) de um bebê não conseguiria vencer a tensão superficial da água nos dois pulmões. É como se na deficiência desses ácidos graxos no líquido dos alvéolos os pulmões fossem mais duros, resistentes à expansão. Imaginem assoprar uma bexiga de parede delgada, menos resistente, e assoprar uma bexiga de parede espessa, bastante resistente. A presença desses sabões no líquido alveolar transforma a parede da bexiga de espessa em delgada.
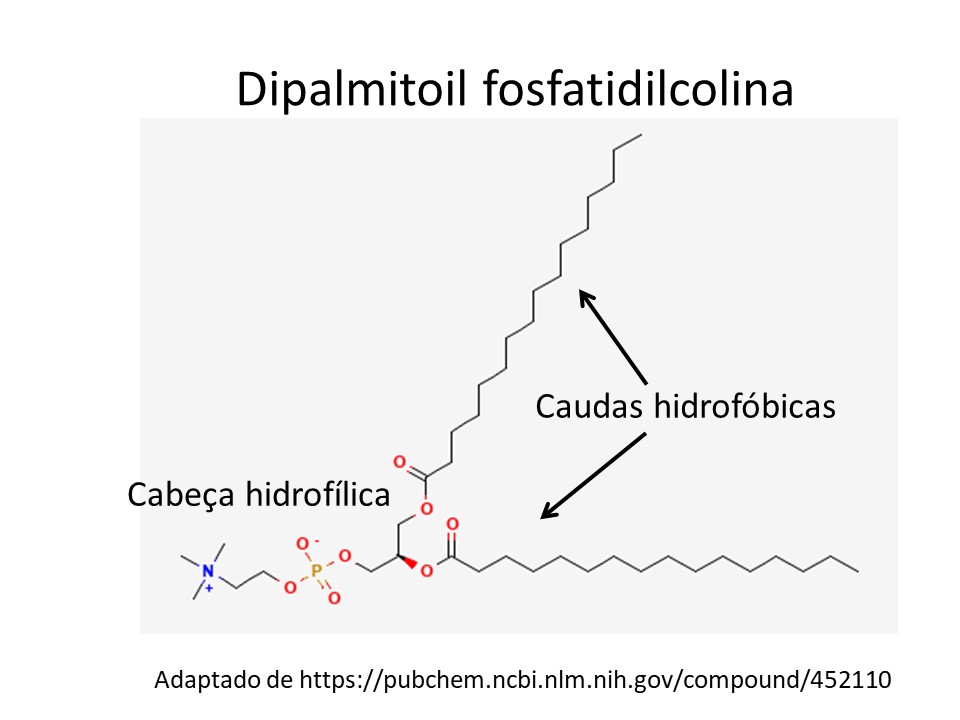
Os pulmões do feto produzem esses ácidos graxos em quantidade adequada, na maioria das vezes, após 34 semanas de gestação. Por isso, bebês que nascem com menos de 34 semanas de gestação têm maior chance (tanto maior quanto mais prematuros) de necessitarem de suporte ventilatório do que aqueles que nascem após esse período de gestação. A mais frequente dessas moléculas no líquido presente nos alvéolos pulmonares é a dipalmitol fostaditilcolina, cuja fórmula molecular está na figura abaixo. Note as duas “caudas” hidrofóbicas e uma “cabeça” hidrofílica.
Felizmente, há tratamento medicamentoso para o feto e para o recém-nascido, reduzindo a necessidade de assistência ventilatória e aumentando as chances de sobrevivência.
Se você leu esse texto, além de agradecer a quem lhe ensinou a Língua Portuguesa, agradeça agora a esses sabões, que também podem ser chamados de surfactantes pulmonares. Encha o peito de ar e diga: “Obrigado, surfactantes pulmonares! Vocês são de dar o fôlego!” Ops, piadinha ruim…
Para saber mais sobre o assunto:
– https://pubchem.ncbi.nlm.nih.gov/ (para explorar a estrutura química de qualquer composto; em inglês).
– https://www.britannica.com/science/surface-tension (texto curto sobre a tensão superficial da água, mas com alguns aspectos físicos de como ela ocorre; em inglês).
– http://birdmanscience.weebly.com/uploads/5/6/5/7/56574945/cell_membrane_bubble_lab_fatsy_honors.pdf (um curso rápido sobre membranas celulares cujo primeiro assunto é sobre membranas de bicamadas lipídicas, entre elas da bolha de sabão; em inglês).
– https://www.science.org/doi/10.1126/science.aab1637 (um texto sobre como cientistas conseguiram desenvolver robôs, à semelhança de insetos, que se mantêm sobre a superfície água e conseguem saltar a partir dela; em inglês).

Euclides de Alexandria e a mesa bamba
Você pode gostar

Luz dos vaga-lumes ilumina a Ciência
abril 27, 2023
Estresse: sucumbir ou perseverar?
maio 14, 2023
Um comentário
Marcela
Que leitura gostosa! Adorei!